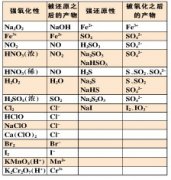
1、了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。
2、了解胶体是一种常见的分散系。
1.胶体的性质及应用
(1)胶体由于分散质粒子直径在1 nm~100 nm之间,表面积大,有强的吸附能力,因而表现出下列特性:
①能通过滤纸而不能透过半透膜——用于悬浊液、胶体、溶液的分离。
②对光的散射作用——一束光通过胶体时产生一条光亮通路——丁达尔效应——鉴别溶液和胶体。
③受水分子从各个方向大小不同的撞击作用——胶粒在胶体中做不停息地、无规则运动——布朗运动——胶体能均一、较稳定存在的原因之一。
④胶粒在胶体溶液内对溶液中的离子发生选择吸附使胶体粒子带电〔例Fe(OH)3胶粒带正电,硅酸胶体的粒子带负电〕——胶粒在外加电场作用下做定向移动——电泳——除尘——胶体能稳定存在的主要原因。
(2)胶粒带电规律:一般来讲金属氧化物及其水化物形成的胶体粒子带正电荷;非金属氧化物及水化物、金属硫化物形成的胶体粒子带负电荷。
(3)胶体的聚沉方法及应用
①加热——加速胶体粒子运动,使之易于结合成大颗粒。
②加入电解质——中和胶粒所带电荷,使之聚结成大颗粒。
③加入带相反电荷的胶体——互相中和电性,减小同种电荷的相互排斥作用而使之聚集成大颗粒。
④应用:如制豆腐、工业制肥皂,解释某些自然现象,如三角洲。
当前位置:主页 > 考试 > 学历类 > 高考 > 各科备考 > 高考化学备考 > >
高考化学考点:溶液与胶体
来源::未知 | 作者:365体育直播|365体育官网APP下载|中国加油** | 本文已影响 人
- 上一篇:学好高中化学应具备的四种能力要求
- 下一篇:高考化学答题如何答出关键性
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教